Les différents types de vaccins développés
Publié en ligne le 14 mai 2021 - Santé et médicament -
Parmi les quelques 236 candidats vaccinaux répertoriés par l’OMS fin janvier 2021 [1], certains correspondent à des approches traditionnelles, tels que les vaccins inactivés ou atténués, et d’autres font appel à des techniques beaucoup plus innovantes, tels que les vaccins utilisant des vecteurs viraux non pathogènes ou de l’ARN messager qui, jusqu’alors, n’avaient été que peu utilisés chez l’Homme [2].
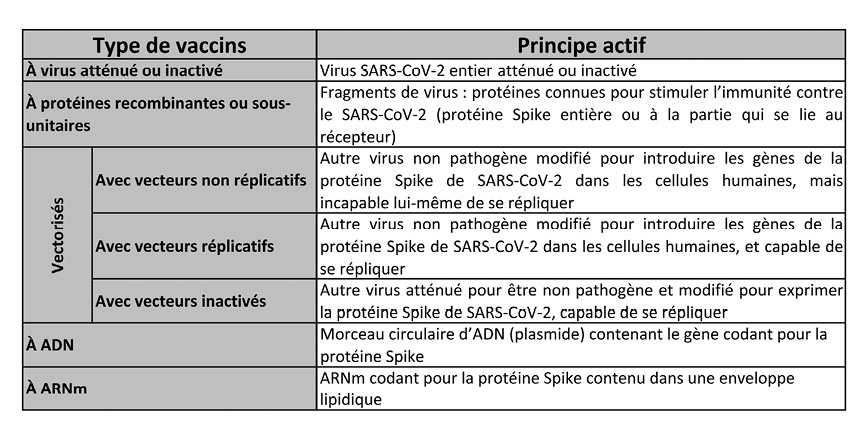
Le tableau ci-dessous synthétise les grandes classes de vaccins en développement contre le SARS-CoV-2. Chaque méthodologie, reposant sur un principe actif stimulant le système immunitaire, présente ses avantages et ses inconvénients.
Vaccins utilisant du virus atténué ou inactivé
L’utilisation de virus atténués ou inactivés est une des techniques les plus classiques, appliquée depuis des décennies dans plusieurs produits vaccinaux.
Les vaccins à virus atténué sont produits en diminuant la capacité de réplication du virus afin qu’il soit sans danger chez un individu ayant une immunité normale. Ils sont obtenus en produisant le virus sous de nouvelles conditions de culture (température, culture sur cellules autres que des cellules humaines) ou par retrait (« délétion ») de certains gènes impliqués dans la capacité de réplication. L’avantage est qu’ils n’induisent pas seulement une réponse contre une protéine cible (pour le SARS-CoV-2, c’est la protéine Spike qui est la cible principale de la majorité des vaccins), mais contre toutes les protéines du virus, ce qui augmente l’efficacité notamment en cas de mutation. Un autre avantage majeur est qu’ils pourraient être administrés par voie nasale et entraîner ainsi une diminution de la réplication virale au sein des voies respiratoires, et donc limiter la transmission du virus. Leur principal inconvénient, puisqu’ils contiennent un virus potentiellement viable, est que celui-ci pourrait se répliquer chez certains sujets ayant une baisse importante de l’immunité. De plus, la quantité de travail nécessaire pour obtenir de tels virus atténués est importante, si bien qu’il n’y a encore que peu de candidats de ce type contre le virus SARS-CoV-2, dont la plupart sont en phase d’études précliniques.

Louis-Léopold Boilly (1761-1845)
Pour les vaccins inactivés, le virus est tué et n’a donc plus de capacité à se reproduire [3]. L’avantage, comme pour les précédents, est qu’ils induisent une réponse contre toutes les protéines du virus limitant l’impact de la survenue de mutations. En revanche, ce processus d’immunisation requiert l’ajout d’un adjuvant pour augmenter la réponse immunitaire au site d’injection. La production recourt à une culture du virus puis à son inactivation par la chaleur ou le phénol. Ce type de vaccin peut être produit facilement, mais nécessite des manipulations du virus in vitro dans des laboratoires avec un haut niveau de sécurité (niveau 3 sur une échelle de 1 à 4). Actuellement (février 2021), plusieurs candidats sont produits selon ce procédé en Chine 1 et en Inde 2, et testés dans plusieurs pays, principalement en Asie et au Brésil.
Vaccins à protéines recombinantes ou vaccins « sous-unitaires »
Ces vaccins reposent sur un procédé très largement utilisé depuis des décennies pour lutter contre d’autres agents infectieux (pneumocoque, méningocoque, coqueluche par exemple). Ils contiennent des composants protéiques identifiés au préalable comme les cibles contre lesquelles on veut induire l’immunité (la protéine Spike du SARS-CoV-2 ou l’une de ses régions). Ces vaccins, dits sous-unitaires, sont issus de l’ingénierie génétique (voir encadré). Les protéines produites par ce procédé sont dites recombinantes et sont utilisées directement dans le vaccin ou transportées à l’aide de pseudo-particules virales (enveloppe virale sans aucun matériel génétique). Ces protéines vont alors être reconnues comme des antigènes étrangers par le système immunitaire et vont induire une réponse spécifique. Les différents candidats vaccinaux anti-SARS-CoV-2 de cette catégorie varient selon le type de protéine utilisée : soit la protéine Spike en entier, soit une partie spécifique de cette protéine [4]. Ils nécessitent également le recours à un adjuvant pour renforcer la stimulation immunitaire. Leur principal avantage est leur sécurité, puisqu’ils ne comportent aucun agent pathogène et utilisent un procédé de stimulation bien connu. Un autre avantage est qu’ils peuvent être produits sans culture virale, donc sans procédures de sécurité renforcées. Certains laboratoires ont déjà une bonne expérience de leur production.
Ces vaccins ont cependant des inconvénients : la protéine Spike entière est assez difficile à synthétiser et à produire en quantité suffisante. Produire une partie sélectionnée de la protéine (principalement la région qui se lie au récepteur des cellules humaines) est plus facile, mais empêche alors les possibilités d’immunisation contre d’autres morceaux de la protéine, ce qui pourrait entraîner plus vite une perte d’efficacité lors de mutations (« variants » du virus). De nombreux vaccins contenant diverses protéines recombinantes sont (en février 2021) en phase d’études précliniques et certains en phase clinique : Novavax aux États-Unis, CovidVax à Cuba (Instituto Finley de Vacunas) et en Chine (Anhui Zhifei Longcom). Comme pour les formulations utilisant des virus inactivés, les vaccins protéiques doivent être injectés dans le muscle ou en sous-cutané et ne peuvent être utilisés pour induire une immunité mucosale par voie nasale.
Vaccins « vectorisés »
Les vaccins à « vecteur viral » utilisent comme transporteur un autre virus très peu pathogène, voire non pathogène, qui a été transformé pour y ajouter du matériel génétique contenant l’information pour synthétiser les protéines cibles du SARS-CoV-2 contre lesquelles on veut induire une réponse immunitaire. Le virus vecteur ainsi modifié infecte localement les cellules des personnes vaccinées, délivre l’information et s’y multiplie ou non selon le type de vecteur choisi. Les cellules infectées fabriquent alors les protéines cibles du SARS-CoV-2, induisant la réponse immunitaire.
Les vaccins avec vecteurs non réplicatifs
Ils représentent un large groupe de vaccins en développement [5, 6, 7]. Le virus vecteur est modifié par recombinaison de manière à pouvoir exprimer la protéine Spike du SARS-CoV-2, alors qu’une partie de son propre génome viral est retiré pour qu’il ne puisse pas se répliquer. Les cellules infectées par ce virus recombinant exprimeront la protéine Spike du SARS-CoV-2 ainsi que d’autres protéines des virus porteurs. L’ensemble de ces protéines étant reconnues étrangères par le système immunitaire, celui-ci enclenchera la réponse spécifique avec production d’anticorps et de cellules cytotoxiques.
Les vaccins sont administrés par voie intramusculaire, et n’entraînent malheureusement pas d’immunité mucosale nécessaire pour limiter la transmission. De nombreux laboratoires et industries ont l’expérience de telles techniques qui ont aussi été appliquées avec succès dans la lutte contre le virus Ebola [8].
Un des inconvénients connus est que les virus utilisés comme vecteurs peuvent être neutralisés par une immunité préexistante résultant de réactions croisées (avec d’autres virus humains ou d’autres composants antigéniques rencontrés antérieurement). C’est pour limiter ce phénomène qu’on utilise des vecteurs rarement rencontrés chez l’être humain ou qui proviennent de virus animaux, ou encore qui induisent une immunité très faible et non persistante. Le fait cependant de les utiliser lors d’une dose de rappel pourrait se heurter à une immunité inhibitrice issue de la première injection. Il est alors possible d’utiliser des vecteurs différents pour l’immunisation initiale et l’immunisation de rappel et ainsi limiter la production d’anticorps qui neutraliseraient le vaccin injecté avant qu’il puisse faire son effet. Plusieurs candidats vaccinaux basés sur ce modèle sont déjà en phase 3 : AstraZeneca/Oxford au Royaume-Uni (commercialisé maintenant), Johnson and Johnson et Janssen Pharmaceutical (soumis pour approbation dans l’Union européenne), AdV5 (CanSino en Chine) et Gam-COVID-Vac (« Spoutnik V ») en Russie (soumis pour approbation dans l’Union européenne).
Les nouvelles technologies génétiques permettent d’obtenir des protéines dites « recombinantes » à partir de procédés génétiques. In vitro, les gènes codant pour la protéine que l’on veut obtenir sont introduits dans des cultures de cellules (levures, insectes, plantes, bactéries) afin d’être traduits en protéines qui sont alors extraites et purifiées. Dans le cas des vaccins, on utilise des cellules pour synthétiser des protéines virales ou bactériennes qui vont être utilisées afin de déclencher la réaction immunitaire voulue.
Les vaccins avec vecteurs réplicatifs
Le principe est exactement le même que pour les vecteurs non réplicatifs, sauf que les vecteurs sont des virus atténués (mais encore capable de se répliquer) qui ont été modifiés pour exprimer la protéine Spike. Cette approche induit une forte immunité car le virus peut se répliquer au site d’injection et produire ainsi une forte quantité d’antigènes. Il peut également servir à infecter les muqueuses nasales et y induire une réponse immunitaire avec production des anticorps IgA spécifiques importants pour limiter la transmission. Un des prototypes en cours, développé par l’institut Pasteur et la société Themis (acquise par Merck), utilise le virus de la rougeole ; il n’est pas sûr cependant qu’il puisse être administré avec une sécurité totale par voie nasale. D’autres vecteurs peuvent être utilisés comme le virus de la stomatite vésiculaire, le virus de la variole du cheval ou le virus de la maladie de Newcastle, ce dernier apparaissant plus sûr pour une administration par voie nasale.
Les vaccins avec vecteurs inactivés
Dans le même ordre d’idée que les vaccins à vecteurs non réplicatifs, quelques vaccins sont proposés pour induire la production d’anticorps neutralisants contre le SARS-CoV-2 grâce à des vecteurs viraux, cette fois inactivés (par la chaleur ou d’autres procédés physico-chimiques), portant la protéine Spike à leur surface. Un des avantages de l’inactivation est que le vecteur est sans danger puisqu’il ne peut se répliquer, même chez les sujets immunodéprimés. La quantité d’antigène administrée peut être spécifiée avec précision. Deux des technologies les plus avancées utilisent le virus de Newcastle ou le virus de la rage. De telles études sont encore en phase préclinique.
Les vaccins à ADN ou à ARN messager
Ces produits en développement récent utilisent une technologie ultra-innovante visant à apporter l’information génétique (directement et non plus par un vecteur) localement à des cellules humaines afin qu’elles puissent fabriquer elles-mêmes des protéines du virus capables ensuite d’induire une réponse immunitaire. Ces vaccins ont le grand avantage de pouvoir être produits in vitro. Leur principal inconvénient, en plus de faire appel à des technologies novatrices sur lesquelles nous n’avons encore que peu de recul bien que déjà utilisées dans d’autres procédés en médecine depuis quelques années [9], est qu’ils sont injectables, limitant leur intérêt pour stimuler une immunité au niveau des muqueuses et empêcher la transmission.
Vaccins à ADN
L’information génétique correspondant à la protéine Spike est transmise sous forme de fragments d’ADN (morceau de chromosome circulaire appelé plasmide). Ceux-ci sont introduits via un petit choc électrique dans le noyau des cellules humaines qui produisent alors les antigènes vaccinaux qui stimuleront à leur tour les cellules immunitaires. L’avantage de telles technologies est leur capacité de production à large échelle (via le processus d’ingénierie génétique détaillé plus haut, utilisant notamment des bactéries comme Escherichia coli) ainsi que leur facilité d’approvisionnement et de stockage due à leur stabilité. Cependant leur capacité de stimulation du système immunitaire est faible. Un certain nombre de candidats sont en phase 1/2 3 des essais cliniques (produits par AnGes en relation avec l’université d’Osaka, Takara Bio avec AGC Biologics).
Vaccins à ARN messager
Dans ce cas, c’est de l’ARN messager dont la séquence correspond à la protéine S qui est utilisé pour délivrer l’information génétique. L’ARNm est incorporé dans des enveloppes lipidiques qui le véhiculent dans les cellules humaines au site d’injection. Il est ensuite traduit par les cellules humaines en protéines Spike qui vont être exprimées et stimuler le système immunitaire. Attention, le code génétique de la cellule elle-même n’est en rien modifié puisque rien n’est introduit dans ses propres chromosomes. Ils ont comme inconvénients une grande instabilité nécessitant un stockage à basse température (-20 à -70 °C) et une faible durée de conservation. Les vaccins ARNm représentent une avancée importante de ces dernières années et ont déjà été testés dans plusieurs études chez l’animal ainsi que chez l’Homme dans des phases 1/2 pour le développement de vaccins contre les virus Zika et HIV-1. Ils ont également été testés dans des thérapies ciblées de cancers métastatiques tels les mélanomes et les cancers coliques [9].
En ce qui concerne les vaccins contre le SARSCoV-2, après des résultats prometteurs chez l’animal et des études de phases 1/2 pour un nombre important de candidats [10, 11, 12], les produits de Moderna et NIH, Pfizer-BioNTech, dont les premières données des essais de phase 3 ont été publiées en décembre 2020, ont été approuvés par les agences de régulation américaine et européenne et sont distribués depuis dans plusieurs pays. Les candidats développés par Curevac et Acturus Therapeutics sont eux en phases 1/2.
1 | OMS, “Draft landscape and tracker of COVID-19 candidate vaccines”, 12 février 2021. Sur who.int
2 | Krammer F, “SARS-CoV-2 vaccines in development”, Nature, 2020, 586 :516-27.
3 | Gao Q et al., “Development of an inactivated vaccine candidate for SARS-CoV-2”, Science, 2020, 369 :77-81.
4 | Chen WH et al., “Yeast-Expressed SARS-CoV Recombinant Receptor-Binding Domain (RBD219-N1) Formulated with Alum Induces Protective Immunity and Reduces Immune Enhancement”, Vaccine, 2020, 38 :7533-41.
5 | Zhu FC et al., “Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older : a randomised, double-blind, placebocontrolled, phase 2 trial”, Lancet, 2020, 396 :479-88.
6 | Logunov DY et al., “Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations : two open, non-randomised phase 1/2 studies from Russia”, Lancet, 2020, 396 :887-97.
7 | Folegatti PM et al., “Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2 : a preliminary report of a phase 1/2, single-blind, randomised controlled trial”, Lancet, 2020, 396 :467-78.
8 | Matz KM et al., “Ebola vaccine trials : progress in vaccine safety and immunogenicity”, Expert Rev Vaccines, 2019, 18 :1229-42.
9 | Pardi N et al., “mRNA vaccines - a new era in vaccinology”,Nat Rev Drug Discov, 2018, 17 :261-79.
10 | Laczkó D et al., “A Single Immunization with NucleosideModified mRNA Vaccines Elicits Strong Cellular and Humoral Immune Responses against SARS-CoV-2 in Mice”, Immunity, 2020, 53 :724-732.e7.
11 | Corbett KS et al., “Evaluation of the mRNA-1273 Vaccine against SARS-CoV-2 in Nonhuman Primates”, N Engl J Med, 2020, 383 :1544-55.
12 | Lu J et al., “A COVID-19 mRNA vaccine encoding SARSCoV-2 virus-like particles induces a strong antiviral-like immune response in mice”, Cell Res, 2020, 30 :936-939.
Publié dans le n° 336 de la revue
Partager cet article
Les auteurs

Sophie Blumental
Pédiatre infectiologue, chef de clinique adjoint à l’unité de maladies infectieuses pédiatriques de l’hôpital (…)
Plus d'informations
Patrice Debré
Professeur émérite de médecine, département d’immunologie, APHP, Sorbonne Université, CIMI (Inserm U1135), Hôpital (…)
Plus d'informationsSanté et médicament

Tests microbiote, science ou pseudo-science ?
Le 31 mai 2023
Quelle expertise pour quel usage ?
Le 4 mars 2024
Les prescriptions hors autorisation de mise sur le marché
Le 24 février 2024













![[Conférence en ligne - Mardi 23 avril 2024 à 20h00] Les révolutions de la recherche sur le cancer](local/cache-gd2/ec/12735272a34aefb87f65b995407f51.png?1713241730)













